سالهای زیادی، این سوال عجیب و جالب در ذهن شیمیدانان به وچود آمده بود که چرا امکان جایگزینی اتمهای کربن توسط اتمهای سیلیکون در ترکیبات آلی و زیستی وجود ندارد و چرا نمیتوانیم حیاتی بر پایهی ترکیبات سیلکیونی داشته باشیم؟ محققان به تازگی در پژوهشی شیمی کوانتومی که در مجلهی معتبر Angewandte Chemie منتشر شد، موفق به یافتن پاسخی مناسب برای این معمای قدیمی در شیمی آلی شدند. محاسبات جدید کوانتومی بر روی مولکولهای C۲، Si۲ و هیدرید های آنها، برای اولین بار تفاوت هندسهی اوربیتالهای الکترونهای درونی مولکولهای آلی (ترکیبات بر پایهی کربن) و همتایان سیلیکونی آنها را نشان دادند. محاسبات جدید کوانتومی وجود عناصر دیگر با رفتار مشابه اتم کربن برای تغییر شکل ساختار گرهی الکترونهای درونی را بر اساس پیوندهای شیمیایی پیشنهاد کردند که به نوبهی خود میتواند برای توسعهی حیاتی مبتنی بر آنها بسیار جذاب باشد! با دیپ لوک همراه باشید…
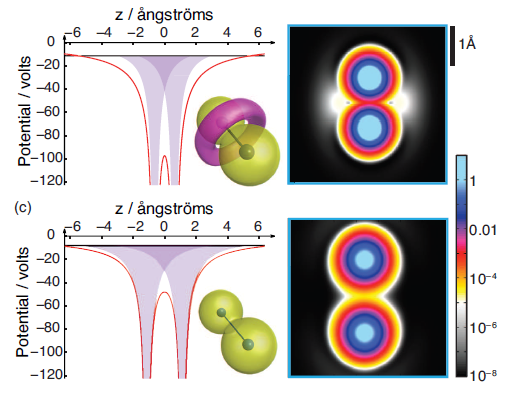
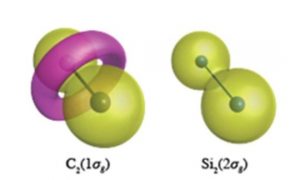
انتظار میرود الکترونهای مرکزی در یک اتم، تابع موجی شبیه به یک بادام زمینی، مانند الکترونهای اوربیتالهای ۲s در اتم سیلیکون (Si2s تصویر سمت راست) داشته باشند. با این حال، در پیوند C-C، الکترونهای اوربیتال ۱s اتم کربن (C1s) به عنوان یک ویژگی، تشکیل قطب مخالف میدهند که در شکل سمت چپ به رنگ صورتی نشان داده شده است.
از زمان کشف سیلیکون و موفقیت ووهر (Wöhler) در سنتز ترکیبات آلی (در اواسط قرن نوزدهم)، او یکی از اولین کسانی بود که پیشنهاد جایگزین کردن اتمهای کربن در ترکیبات آلی را با اتمهای سیلیکون ارائه کرد. در اوایل قرن بیستم دانشمندان به این باور رسیده بودند که اتمهای سیلیکون، شیمی مشابه اتمهای کربن ندارند و رویای حیات بر پایه اتمهای سیلیکون، به یک رویای خیالی تبدیل شده بود. به شکل تجربی میدانیم که اتمهای کربن توانایی تشکیل انواع مختلف ترکیبات غیر اشباع را دارند، در صورتی که سیلیکون، این توانایی را ندارد. با این وجود، دلیل اصلی اینکه چرا فقط کربن این توانایی را دارد، هنوز برای دانشمندان معمایی پیچیده به شمار میآمد. محاسبات شیمی کوانتومی بسیار دقیق، نشان دادند الکترونهای درونی (که انتظار میرود در پیوندهای شیمیایی مشارکتی ندشته باشند)، نقشی بسیار متفاوت در ترکیبات غیر اشباع کربنی و سیلیکونی ایفا میکنند.
اتمهای کربن تمایل دارند هندسه (ساختار گرهی) الکترونهای درونی خود را تغییر دهند که برای نتایج به دست آمده برای مولکول C۲ منجر به تشکیل یک حلقه در اوربیتالهای سیگمای پیوندی (۱σg) ناشی از الکترونهای اوربیتالهای ۱s اتم کربن میگردد.این در حالی است Si۲، شکل کروی اوربیتالهای درونی خود را در هر موقعیتی در تمام این مولکولها حفظ می کند. این انعطافپذیری اوربیتالهای درونی اتم کربن به آنها اجازه میدهد ساختارهای پیوندی متنوعی تشکیل دهند، در حالیکه تشکیل پیوند در ترکیبات سیلیکونی به ساختارهای پیوندی متعامد (orthogonal) به اوربیتال درونی کروی محدود میشود.
با توجه به این نکته که الکترونهای درونی تا به امروز در تشکیل پیوندهای شیمیایی اغلب بی اثر در نظر گرفته میشدند، این کشف میتواند بسیار مهم باشد. شاید لازم باشد سهم این اوربیتالها را در پیوندهای شیمیایی دوباره مورد ارزیابی قرار دهیم (حداقل در ترکیبات غیر اشباع اینگونه است). در نهایت، نتایج به دست آمده از این محاسبات پیشنهاد میکند که عناصر دیگر مانند نیتروژن، فسفر و فلوئور، انعطافپذیری مشابهی برای تغییر هندسهی الکترونهای درونی خود داشته باشند و به همین ترتیب، شیمی جذاب و مشابه با کربن از خود نشان دهند.




گفتگو۶ دیدگاه
خیلی خوشحالم که این وبسایتو پیدا کردم. مطالبتون واقعا برای من جالبن. موفق باشید.
سپاسگزارم. ما هم خوشحالیم که مطالب دیپ لوک برای شما جالب بوده
بسیار عالی و ارزشمند هست این سایت. متشکرم
یک سوال در مورد کیفیت chelate شدن عنصری مثل آهن دارم که آیا اسپین آهن در چگونگی chelation مهم است؟ مثلا آهنی که با بنیان اتیلنی کیلیت میش ود با اهنی که با بنیان NTA کیلیت میشود دارای اسپینهای متفاوتی است؟
سلام.
نحوه کی لیت شدن تفاوتی نداره اما در پایداری کی لیت تشکیل شده تفاوت دارند. در بدن انسان ترکیبات کی لیت آهن با اسپین بالا پایدارتر هستند. ضمن اینکه اسپین آهن وابسته به نوع مولکول کی لیت شونده دارد. برای اطلاعات بیشتر به مقاله زیر رجوع کنید:
A theoretical study on the electronic structures and equilibrium constants evaluation of Deferasirox iron complexes.
مرسی ، 🙂
سلام مطلب بسیار آموزنده ای بود سپاس از شما